Che cos’è il pH e come si misura
Nel vasto panorama della chimica, uno dei concetti fondamentali e universalmente riconosciuti è il pH. Questa sigla enigmatica, apparentemente semplice, nasconde un mondo di complessità e importanza innumerevole nell’ambito scientifico e oltre. Il pH, nato come concetto nella prima metà del XIX secolo, è divenuto una chiave di lettura per comprendere l’equilibrio chimico degli elementi che ci circondano.
Indice
Origini e significato
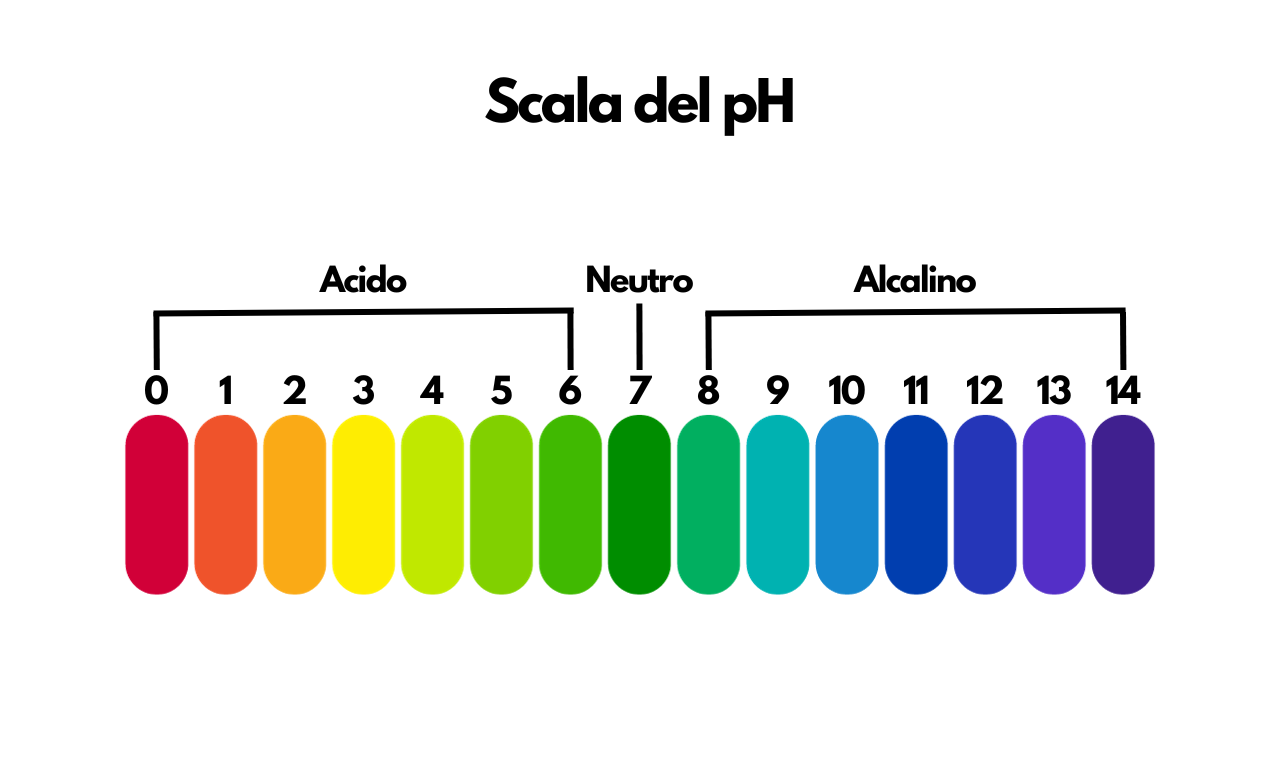
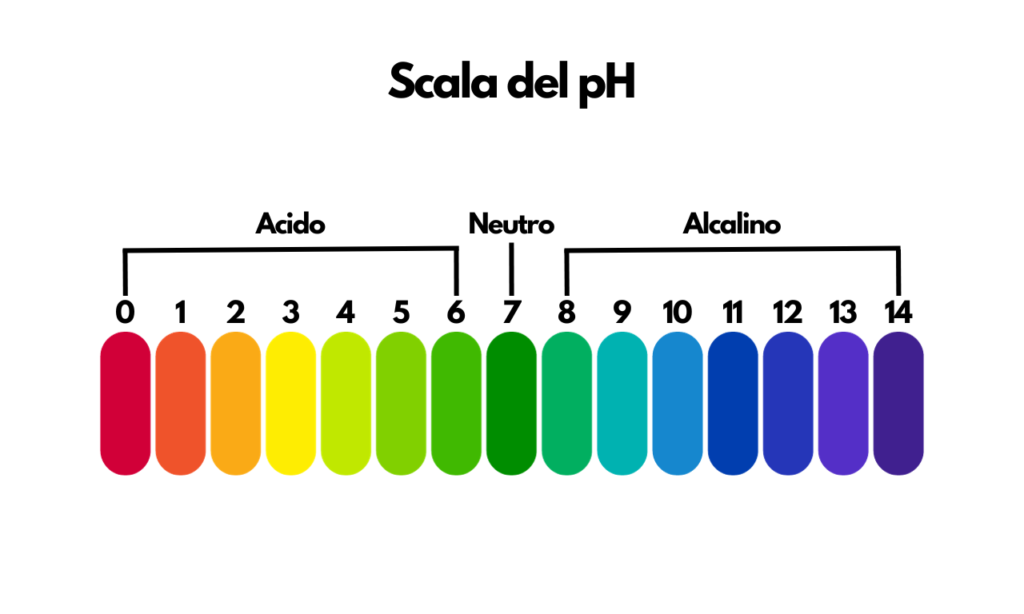
Per comprendere appieno il pH, dobbiamo esplorare le sue radici. Il termine stesso è un’abbreviazione di “potenziale di idrogeno”. Fu introdotto nel 1909 da Søren Sørensen, un chimico danese, come modo per misurare la concentrazione degli ioni di idrogeno in una soluzione. La scala del pH è una misura che va da 0 a 14, dove il valore 7 indica una soluzione neutra, valori inferiori a 7 indicano soluzioni acide e valori superiori indicano soluzioni basiche o alcaline.
Il pH viene calcolato attraverso una formula matematica:
pH = -log[H+]
Dove [H+] rappresenta la concentrazione degli ioni idrogeno nella soluzione. Il logaritmo negativo dell’attività degli ioni idrogeno stabilisce il valore di pH. Questo parametro è cruciale in numerose discipline, dall’agricoltura alla biologia, dalla medicina alla chimica industriale.
Significato e implicazioni del pH nella natura e nella vita quotidiana
L’importanza del pH si manifesta in molteplici ambiti. Nel regno naturale, molti processi biologici e chimici dipendono fortemente dalla corretta acidità o basicità dell’ambiente circostante. Ad esempio, nel corpo umano, il sangue mantiene un pH compreso tra 7,35 e 7,45 per garantire il corretto funzionamento delle cellule e degli organi. Variazioni anche minime da questo intervallo possono comportare gravi conseguenze sulla salute.
Nel mondo agricolo, la fertilità del suolo è strettamente legata al suo pH. Coltivazioni specifiche richiedono specifiche condizioni di acidità o basicità per crescere in modo ottimale. Allo stesso modo, nell’industria alimentare, il pH gioca un ruolo critico nella conservazione degli alimenti e nella determinazione del loro sapore e stabilità.
Le acque naturali, come fiumi, laghi e mari, sono influenzate dal pH, il quale incide direttamente sulla salute degli ecosistemi acquatici. Variazioni significative nel pH possono mettere a rischio la vita marina e gli habitat circostanti.
Metodi di misurazione del pH
La misurazione del pH può essere effettuata utilizzando diversi strumenti. Il più comune è il pHmetro, un dispositivo che utilizza un elettrodo per rilevare la concentrazione di ioni H+ in una soluzione. I test di laboratorio, come le strisce reattive o le soluzioni indicatori di pH, sono altrettanto diffusi e accessibili per misurazioni più semplici.
Calcolo del pH e del pOH
Il pH misura l’acidità di una soluzione e il pOH misura la sua basicità. La relazione tra pH e pOH è data dalla seguente equazione:
pH + pOH = 14
Calcolo del pH:
Il pH si calcola come il logaritmo negativo della concentrazione di ioni idrogeno [H+]:
pH = −log[H+]
Calcolo del pOH:
Il pOH si calcola come il logaritmo negativo della concentrazione di ioni idrossido [OH−]:
pOH = −log[OH−]
Calcolo della concentrazione degli Ioni
Se conosci il pH, puoi trovare la concentrazione di [H+] :
[H+] = 10-pH
Se conosci il pOH, puoi trovare la concentrazione di [OH−] :
[OH−] = 10−pOH
Uso della costante dell’acqua
In acqua pura e nelle soluzioni acquose, la somma dei prodotti delle concentrazioni di H+ e OH− è costante a temperatura ambiente (25°C):
[H+] ⋅ [OH−] = 1 × 10−14
Questa è la costante di dissociazione dell’acqua (Kw). Puoi usarla per trovare una delle concentrazioni se conosci l’altra:
[OH-] = 1 × 10-14/[H+]
[H+] = 1 × 10-14/[OH-]
Calcolatore di pH e pOH
Variazioni e regolazioni del pH
Il pH è una caratteristica dinamica che può variare per molteplici ragioni. Reazioni chimiche, processi biologici o fattori esterni possono influenzare il pH di una soluzione. L’aggiunta di acidi o basi modificherà direttamente il pH di una soluzione acquosa.
Per mantenere un pH stabile e ottimale in determinati contesti, si possono impiegare sostanze chiamate buffer. I buffer sono soluzioni in grado di resistere a variazioni significative del pH, aiutando a mantenere un ambiente relativamente costante.
Conclusioni
Il pH non è solo un numero su una scala, ma una finestra sull’equilibrio chimico che sostiene la vita e la salute del nostro pianeta. Dalla regolazione delle funzioni corporee alla crescita delle colture, dalla qualità delle acque naturali alla sicurezza alimentare, il pH gioca un ruolo cruciale in una vasta gamma di processi.
Mantenere il giusto equilibrio di pH è fondamentale per il benessere degli esseri viventi e per il funzionamento ottimale degli ecosistemi. La nostra capacità di misurare, comprendere e regolare il pH ci permette di migliorare la qualità della vita, proteggere l’ambiente e innovare in settori chiave come l’agricoltura, la medicina e l’industria.
In un mondo in cui i cambiamenti climatici e le attività umane influenzano sempre più i sistemi naturali, la comprensione del pH e delle sue dinamiche è più importante che mai. Investire nella ricerca e nell’educazione sul pH può aiutarci a sviluppare soluzioni sostenibili e a preservare l’equilibrio delicato della nostra biosfera.
L’esplorazione del pH continua a offrire nuove scoperte e applicazioni, rendendolo un campo dinamico e vitale per il progresso scientifico e tecnologico. La sfida e la responsabilità di mantenere un equilibrio chimico nel nostro ambiente ci invita a valorizzare e approfondire la nostra conoscenza di questo fondamentale parametro.