Il microRNA è il regolatore principale del genoma, vincitore del premio Nobel
Quando negli anni ’80 Victor Ambros e Gary Ruvkun scoprirono una nuova molecola che chiamarono microRNA, si trattò di un’affascinante deviazione da quello che per decenni era stato definito il dogma centrale della biologia molecolare.
Insigniti del Premio Nobel per la fisiologia o la medicina nel 2024, Ambros e Ruvkun hanno identificato un nuovo tipo di materiale genetico che ha trasformato il modo in cui i ricercatori concepiscono la regolazione genica.
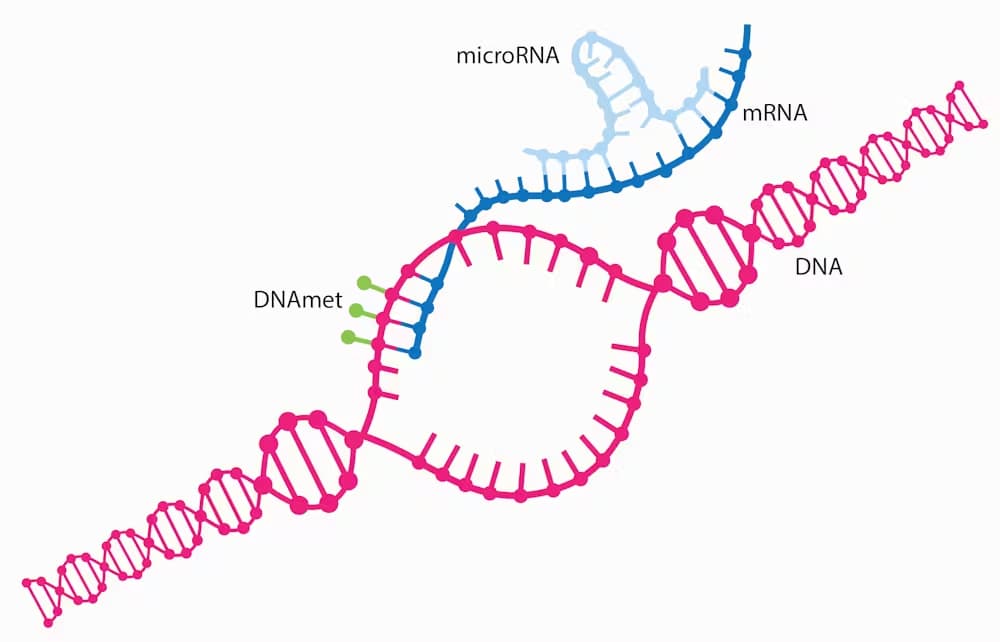
Come il DNA, l’RNA è una forma di materiale genetico costituito da singoli nucleotidi collegati in catene. Secondo il dogma centrale, le informazioni genetiche fluiscono in una direzione: il DNA viene trascritto in RNA e l’RNA viene tradotto in proteine. Ma in una deviazione importante dal dogma centrale, alcuni RNA non vengono mai tradotti o codificati in proteine.
I microRNA sono un tipo di questi cosiddetti RNA non codificanti. Sono brevi tratti di materiale genetico che, anziché codificare per una proteina specifica, controllano gli RNA che codificano per le proteine. In effetti, i microRNA attivano e disattivano determinati geni.
Il riconoscimento del premio Nobel per le molecole di microRNA ne sottolinea sia l’importanza in biologia sia la promessa come potenziali trattamenti per varie malattie, tra cui il cancro.
MicroRNA e malattie
Gli scienziati considerano i microRNA come regolatori master del genoma, grazie alla loro capacità di legarsi e alterare l’espressione di molti RNA che codificano proteine. Infatti, un singolo microRNA può regolare da 10 a 100 RNA che codificano proteine. Invece di tradurre il DNA in proteine, possono invece legarsi agli RNA che codificano proteine per silenziare i geni.
Il motivo per cui i microRNA possono regolare un pool di RNA così diversificato deriva dalla loro capacità di legarsi a RNA target con cui non si abbinano perfettamente. Ciò significa che un singolo microRNA può spesso regolare un pool di target che sono tutti coinvolti in processi simili nella cellula, portando a una risposta potenziata.
Poiché un singolo microRNA può regolare più geni, molti microRNA possono contribuire alla malattia quando diventano disfunzionali.
Nel 2002, i ricercatori hanno identificato per la prima volta il ruolo dei microRNA disfunzionali nelle malattie attraverso pazienti con un tipo di tumore del sangue e del midollo osseo chiamato leucemia linfatica cronica. Questo tumore deriva dalla perdita di due microRNA normalmente coinvolti nel blocco della crescita delle cellule tumorali. Da allora, gli scienziati hanno identificato oltre 2.000 microRNA nelle persone, molti dei quali sono alterati in varie malattie.
Il campo ha sviluppato una comprensione abbastanza solida di come la disfunzione del microRNA contribuisca alla malattia. Cambiare un microRNA può cambiare molti altri geni, con conseguente pletora di alterazioni che possono rimodellare collettivamente la fisiologia della cellula. Ad esempio, oltre la metà di tutti i tumori ha un’attività significativamente ridotta in un microRNA chiamato miR-34a. Poiché miR-34a regola molti geni coinvolti nella prevenzione della crescita e della migrazione delle cellule tumorali, la perdita di miR-34a può aumentare il rischio di sviluppare il cancro.
I ricercatori stanno studiando l’utilizzo dei microRNA come terapia per il cancro, le malattie cardiache, le malattie neurodegenerative e altre. Mentre i risultati in laboratorio sono stati promettenti, portare i trattamenti con microRNA in clinica ha incontrato molteplici sfide. Molte sono legate alla somministrazione inefficiente nelle cellule bersaglio e alla scarsa stabilità, che ne limitano l’efficacia.
Fornitura di microRNA alle cellule
Uno dei motivi per cui è difficile somministrare trattamenti a base di microRNA alle cellule è che i trattamenti a base di microRNA devono essere somministrati specificamente alle cellule malate, evitando quelle sane. A differenza dei vaccini a base di mRNA contro il COVID-19 che vengono assorbiti dalle cellule immunitarie che si occupano di scavenging, il cui compito è quello di rilevare materiali estranei, i trattamenti a base di microRNA devono ingannare il corpo facendogli credere di non essere estranei, per evitare l’attacco immunitario e raggiungere le cellule interessate.
Gli scienziati stanno studiando vari modi per somministrare trattamenti microRNA alle loro specifiche cellule bersaglio. Un metodo che sta riscuotendo molta attenzione si basa sul collegamento diretto del microRNA a un ligando, un tipo di piccola molecola che si lega a specifiche proteine sulla superficie delle cellule. Rispetto alle cellule sane, le cellule malate possono avere un numero sproporzionato di alcune proteine di superficie, o recettori. Quindi, i ligandi possono aiutare i microRNA a dirigersi specificamente verso le cellule malate evitando le cellule sane. Il primo ligando approvato dalla Food and Drug Administration statunitense per somministrare piccoli RNA come i microRNA, N-acetilgalattosammina o GalNAc, somministra preferibilmente RNA alle cellule epatiche.
L’identificazione di ligandi in grado di fornire piccoli RNA ad altre cellule richiede la ricerca di recettori espressi a livelli sufficientemente elevati sulla superficie delle cellule bersaglio. In genere, sono necessarie oltre un milione di copie per cellula per ottenere una distribuzione sufficiente del farmaco.
Un ligando che spicca è il folato, noto anche come vitamina B9, una piccola molecola critica durante i periodi di rapida crescita cellulare come lo sviluppo fetale. Poiché alcune cellule tumorali hanno oltre un milione di recettori del folato, questo ligando offre sufficienti opportunità per fornire abbastanza RNA terapeutico per colpire diversi tipi di cancro. Ad esempio, un laboratorio ha sviluppato una nuova molecola chiamata FolamiR-34a, folato legato a miR-34a, che ha ridotto le dimensioni dei tumori al seno e ai polmoni nei topi.
Rendere i microRNA più stabili
Un’altra sfida nell’uso di piccoli RNA è la loro scarsa stabilità, che porta alla loro rapida degradazione. Pertanto, i trattamenti basati su RNA sono generalmente di breve durata nel corpo e richiedono dosi frequenti per mantenere un effetto terapeutico.
Per superare questa sfida, i ricercatori stanno modificando i piccoli RNA in vari modi. Mentre ogni RNA richiede uno specifico schema di modifica, cambiamenti riusciti possono aumentare significativamente la loro stabilità. Ciò riduce la necessità di dosaggi frequenti, diminuendo di conseguenza l’onere e il costo del trattamento.
Ad esempio, i GalNAc-siRNA modificati, un’altra forma di piccoli RNA, riducono il dosaggio da ogni pochi giorni a una volta ogni sei mesi nelle cellule non in divisione. Un team ha sviluppato ligandi di folato legati a microRNA modificati per il trattamento del cancro che hanno ridotto il dosaggio da una volta ogni due giorni a una volta alla settimana. Per malattie come il cancro in cui le cellule si dividono rapidamente e diluiscono rapidamente il microRNA somministrato, questo aumento di attività è un progresso significativo nel campo. Si prevede che questo risultato faciliterà l’ulteriore sviluppo di questo microRNA legato al folato come trattamento del cancro negli anni a venire.
Molti laboratori stanno lavorando per sviluppare trattamenti basati sulle scoperte fatte dai nuovi premi Nobel Ambros e Ruvkun decenni fa. Sebbene ci sia ancora molto lavoro da fare per superare gli ostacoli associati ai trattamenti con microRNA, è chiaro che l’RNA si mostra promettente come terapia per molte malattie.