Tavola periodica: elementi e struttura
La tavola periodica è un’icona intramontabile che si trova in molti laboratori e aule scolastiche, ma va oltre: è stampata su magliette, tazze, asciugamani da spiaggia e molti altri oggetti. Addirittura, ha ispirato una raccolta di racconti e una canzone. Tom Lehrer, professore di matematica a Harvard e cantautore satirico americano, nel 1959 creò la sua celebre canzone “The Elements”, che includeva tutti gli elementi conosciuti fino a quel momento.
Da allora, la tavola periodica ha subito varie modifiche, con l’aggiunta di nuovi elementi, tra cui quattro approvati nel 2016 dall’Unione Internazionale di Chimica Pura e Applicata (IUPAC). Ma cosa rappresenta esattamente la tavola periodica?
In breve, è un tentativo di organizzare la collezione di elementi, ovvero tutte le sostanze pure composte da un singolo tipo di atomo. Esistono due modi per comprendere come la tavola periodica è costruita: basandosi sulle proprietà osservate degli elementi in essa contenuti o sulla costruzione subatomica degli atomi che costituiscono ciascun elemento.

Gli elementi
Quando gli scienziati iniziarono a collezionare elementi nei secoli XVIII e XIX, identificandone lentamente di nuovi nel corso di decenni di ricerca, iniziarono a notare schemi e somiglianze nelle loro proprietà fisiche. Alcuni erano gas, alcuni erano metalli lucidi, alcuni reagivano violentemente con l’acqua e così via.
In quel periodo, la struttura degli atomi non era nota. Gli scienziati iniziarono a cercare modi per disporli in modo sistematico in modo che proprietà simili potessero essere raggruppate insieme, proprio come qualcuno che raccoglie conchiglie potrebbe cercare di organizzarle per forma o colore.
Questa impresa fu resa più difficile perché non tutti gli elementi erano noti, lasciando spazi vuoti che rendevano difficile decifrare i modelli, come cercare di assemblare un puzzle con pezzi mancanti.
Diversi scienziati proposero tavole diverse. La prima versione della tavola periodica attuale è generalmente attribuita al chimico russo Dmitri Mendeleev nel 1869, con una versione aggiornata nel 1871.

Un aspetto importante del contributo di Mendeleev è che lasciò spazi vuoti nella tavola dove pensava dovessero essere collocati elementi mancanti. Nel tempo, questi spazi furono riempiti e la versione finale che conosciamo oggi emerse.
Gli atomi
Per comprendere davvero la struttura finale della tavola periodica, è necessario capire un po’ degli atomi e del loro funzionamento. Gli atomi hanno un nucleo centrale composto da particelle più piccole chiamate protoni e neutroni.
È il numero di protoni a conferire a un elemento il suo numero atomico, generalmente situato nell’angolo in alto a sinistra di ogni casella nella tavola periodica.
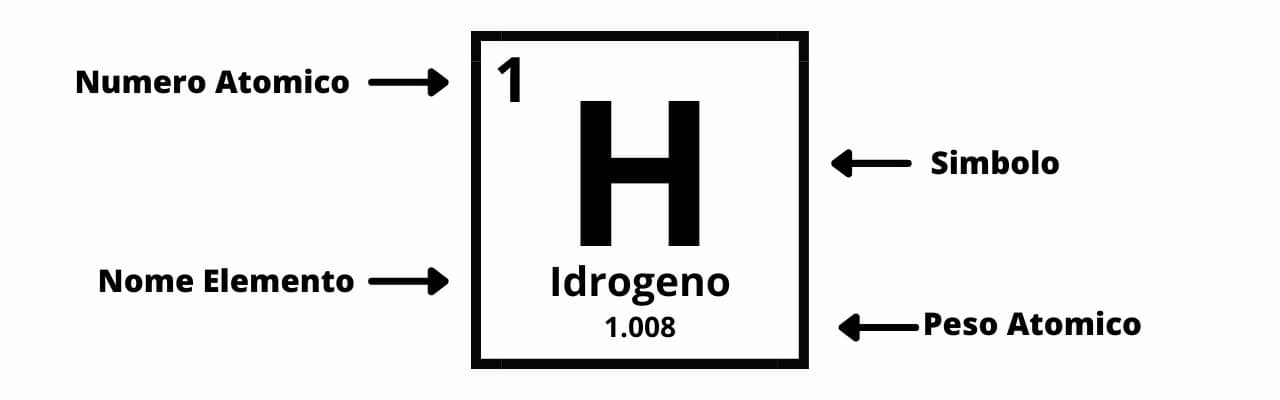
La tavola periodica è organizzata in base all’aumento del numero atomico da sinistra a destra e dall’alto in basso, andando dall’elemento 1 (idrogeno H) in alto a sinistra, al nuovo elemento 118 (oganesson Og) in basso a destra.
Il numero di neutroni nel nucleo può variare, dando origine a diversi isotopi per ogni elemento. Ad esempio, il carbonio-14 è un isotopo radioattivo del carbonio normale (o carbonio-12) che ha due neutroni aggiuntivi.
Ma perché c’è una casella separata di elementi sotto la tavola principale e perché la tavola principale ha una forma strana, con un morso preso nella parte superiore? Questo dipende da come sono organizzati gli altri componenti dell’atomo: gli elettroni.
Gli elettroni
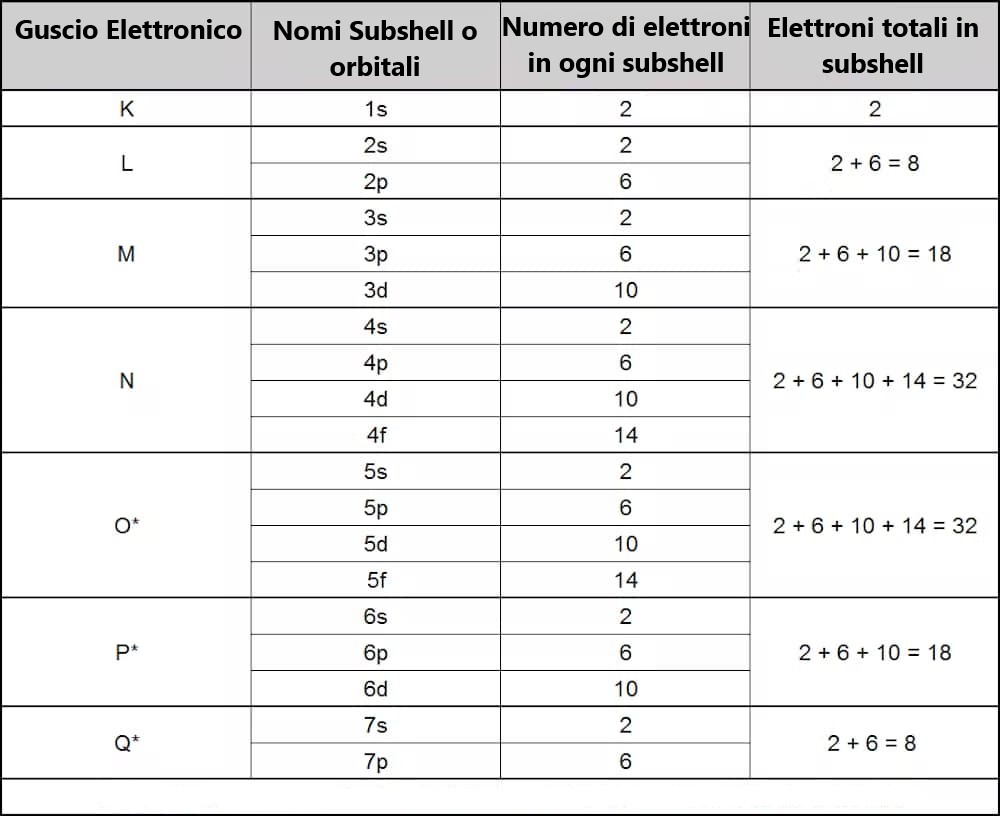
Solitamente pensiamo agli atomi come a cipolle, con sette strati di elettroni chiamati “strati” K, L, M, N, O, P e Q, che circondano il nucleo centrale. Ogni riga nella tavola periodica corrisponde a riempire uno di questi strati con elettroni. Ogni strato ha dei sottolivelli, e l’ordine in cui questi sottolivelli vengono riempiti è basato sull’energia richiesta.
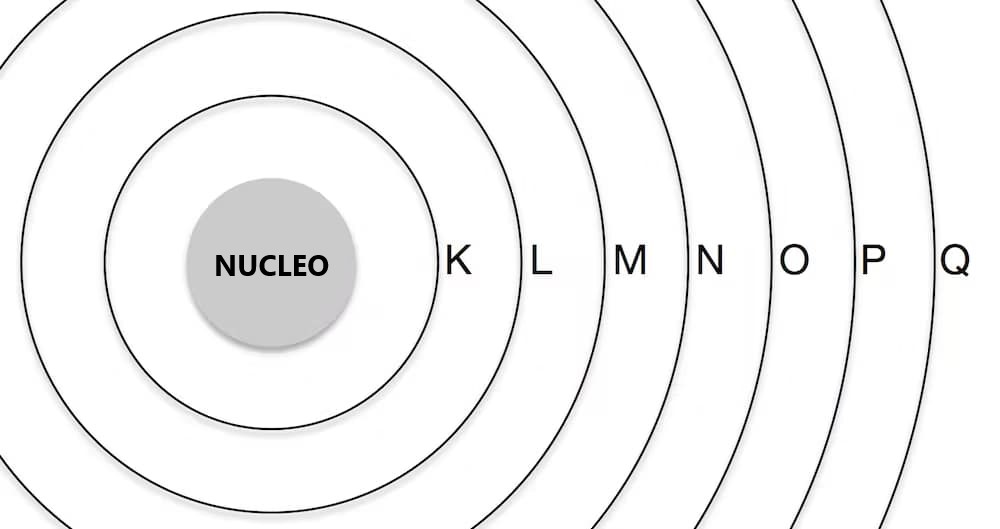
In termini semplici, il primo elemento in ogni riga inizia uno strato nuovo contenente un elettrone, mentre l’ultimo elemento in ogni riga ha due (o uno per la prima riga) dei sottolivelli nello strato esterno completamente occupati. Queste differenze negli elettroni sono responsabili di alcune delle somiglianze nelle proprietà tra gli elementi.
Gli elementi nell’ultima colonna, come elio He, neon Ne, argon Ar, ecc., sono chiamati gas nobili (o gas inerti), sono tutti gas e sono “nobili” perché raramente si associano ad altri elementi. Al contrario, gli elementi della prima colonna, ad eccezione dell’idrogeno, sono chiamati metalli alcalini. Gli elementi nella prima colonna hanno caratteristiche simili a quelle dei metalli, ma con un solo elettrone nello strato esterno, sono molto reattivi in quanto questo singolo elettrone è molto facile da coinvolgere nella formazione di legami chimici. Quando vengono aggiunti all’acqua, reagiscono rapidamente per formare una soluzione alcalina (basica).
Ogni strato può contenere un numero crescente di elettroni. Il primo strato (K) può ospitare solo due elettroni, quindi la prima riga della tavola periodica ha solo due elementi: l’idrogeno (H) con un elettrone e l’elio (He) con due.
Il secondo strato (L) può contenere otto elettroni. Pertanto, la seconda riga della tavola periodica contiene otto elementi, con uno spazio vuoto tra idrogeno e elio per ospitare i sei elettroni aggiuntivi.
Il terzo strato (M) può contenere 18 elettroni, ma la terza riga ha ancora solo otto elementi. Ciò è dovuto al fatto che i dieci elettroni aggiuntivi vengono aggiunti a questo strato solo dopo che i primi due elettroni sono stati aggiunti al quarto strato (N) (ne parleremo più avanti). Quindi lo spazio è ampliato nella quarta riga per ospitare i dieci elementi aggiuntivi, dando origine al “morsa” sulla parte superiore della tavola. Gli elementi extra in questa sezione sono chiamati metalli di transizione.
Il quarto strato contiene 32 elettroni, ma anche in questo caso gli elettroni aggiuntivi vengono aggiunti a questo strato solo dopo che ne sono stati aggiunti alcuni anche al quinto (O) e al sesto (P), il che significa che la quarta e la quinta riga contengono entrambe 18 elementi.
Per le due righe successive (sesta e settima), invece di ampliare ulteriormente la tavola in orizzontale per includere questi 14 elementi aggiuntivi, che renderebbe difficile la lettura, sono stati inseriti come un blocco di due righe, chiamate lantanoidi (elementi 57-71) e attinoidi (elementi 89-103), sotto la tavola principale.
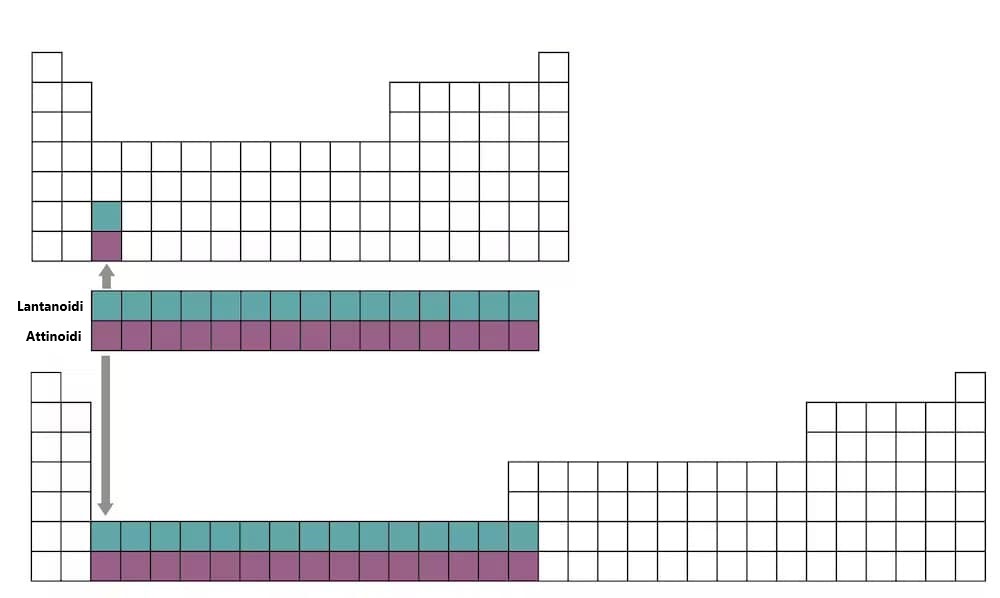
Puoi vedere dove andrebbero se la tavola periodica fosse allargata, guardando gli ultimi due quadrati nella terza colonna della tavola qui sopra.
Le colonne della tavola periodica
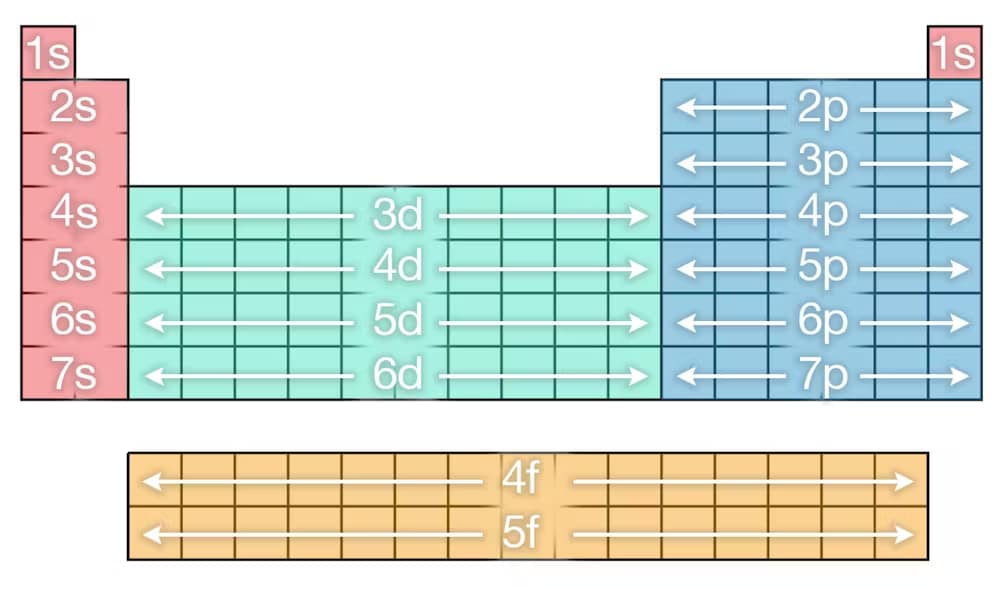
C’è un altro fattore complicante che porta alla forma finale della tavola. Come accennato in precedenza, mentre gli elettroni vengono aggiunti a ogni strato, entrano in diversi sottolivelli (o orbitali), che descrivono le posizioni intorno al nucleo dove sono più probabili. Questi sono noti con le lettere s, p, d e f.
Le lettere usate per gli orbitali sono in realtà derivate dalle descrizioni dell’emissione o assorbimento di luce dovuto agli elettroni che si muovono tra gli orbitali: acuto, principale, diffuso e fondamentale.
Ogni strato ha la sua configurazione di sottolivelli denominati da 1s a 7p, che fornisce il numero totale di elettroni in ogni strato man mano che si avanza attraverso la tavola periodica.
Come accennato in precedenza, l’ordine in cui si riempiono gli orbitali non è così semplice. Puoi vedere l’ordine in cui si riempiono dall’immagine qui sotto, seguendo l’ordine come se stessi leggendo da sinistra a destra.
Esiste una tavola periodica interattiva che illustra anche bene la sequenza di riempimento se fai clic attraverso gli atomi.
Gli elementi all’interno di una colonna hanno generalmente proprietà simili, ma in alcuni casi gli elementi affiancati possono anche essere simili. Ad esempio, nei metalli di transizione, il gruppo di metalli preziosi intorno al rame (Cu), argento (Ag), oro (Au), palladio (Pd) e platino (Pt) sono piuttosto simili.
La maggior parte degli elementi esistenti con numeri atomici elevati, inclusi i quattro elementi superpesanti aggiunti nel 2016, sono molto instabili e non sono mai stati rilevati o isolati dalla natura. Invece, vengono creati e analizzati in quantità minime in condizioni altamente artificiali. Teoricamente, potrebbero esistere ulteriori elementi oltre al 118 ora conosciuti (ci sono suborbitali aggiuntivi g, h e i), ma non sappiamo ancora se alcuni di essi sarebbero abbastanza stabili da essere isolati.